Extras din proiect
Introducere
Metanul, CH4, este cea mai simplă din clasa hidrocarburilor aciclice saturate, numite alcani sau parafine, este foarte răspândit în natură. Gazele naturale sunt amestecuri de diferite hidrocarburi saturate în care predomină de obicei metanul.
Metanul se produce acolo unde a avut loc o fermentare a celulozei în absenţa aerului, sub influenţa unor bacterii anaerobe; de aceea, din fundul bălţilor, unde continuu putrezesc plante, se degajă deseori metan. Datorită acestui proces, metanului se mai spune şi gaz de baltă. [1]
Metanul este un component (20-30%) al gazului de iluminat rezultat prin distilarea uscată a huilei. Separarea metanului din gazul de iluminat constituie un izvor pentru obţinerea lui în ţările bogate în zăcăminte de cărbune. [1]
Ca şi petrolul, gazul metan se extrage din zăcăminte prin sonde. De la locul extracţiei, el este trimis prin conducte până la centrele de consum. [1]
În laborator, metanul se poate prepara prin reacţia dintre apă şi carbura de aluminiu (metoda Moissan):
Al4C3 + 12H20 = 2CH4 + 4Al(OH)3
O altă metodă de laborator este descompunerea acetatului de sodiu (sau de potasiu) prin încălzire cu calce sodată (metoda Dumas):
CH3-COONa + NaOH → CH4 + Na2CO2
Metanul este un gaz incolor, fără miros, mai uşor decât aerul. Este foarte puţin solubil în apă (sub 1%), dar este solubil în alcool şi eter. [1]
Metanul arde cu flacără puţin luminoasă, cu degajare de multă căldură (circa 8600 kcal/m3). Un amestec de metan şi oxigen sau aer explodează în prezenţa unei scânteie. Aşa se explică exploziile care se produc uneori în minele de cărbuni, unde se găsesc cantităţi însemnate de metan. [1]
Prin arderea metanului cu cantităţi reduse de aer, rezultă, după condiţiile de reacţie, carbon şi vaproi de apă sau oxid de carbon şi hidrogen:
2CH4 + O2 = 2CO + 4H2
Metanul arde în clor şi rezultă carbon şi acid clorhidric:
CH4 + 2Cl2 = C + 4HCl
Descompunerea termică a metanului duce la formarea de carbon şi hidrogen:
CH4 → C + 2H2
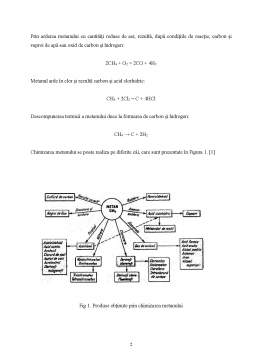
Chimizarea metanului se poate realiza pe diferite căi, care sunt prezentate în Figura 1. [1]
Fig 1. Produse obţinute prin chimizarea metanului
Capitolul 1
Prezentarea ecuaţiei de reacţie chimică
Reacţia chimică, arderea metanului, este poate cea mai importantă proprietate chimică a metanului. Reacţia este cunoscută ca şi combustia metanului. [2]
În prezenţă de oxigen sau aer, la temperaturi ridicate, metanul este oxidat până la dioxid de carbon şi apă:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
La temperatură înaltă şi în prezenţa unui execes de oxigen, metanul se aprinde şi arde cu flacără luminoasă. Această reacţie a metanului, este exotermă, stă la baza folosirii lui drept combustibil. [1]
Arderea este o reacţie generală a tuturor compuşilor organici, însoţită de degajare de energie sub formă de căldură (căldura de ardere sau combustie). [2]
Arderea compuşilor organici până la stadiul de dioxid de carbon şi apă stă la baza metodei analizei elementare cantitative. [2]
Preview document
Conținut arhivă zip
- Metanul.doc